Se il pensiero di andare sotto i ferri ti riempie di paura, puoi stare tranquillo. La chirurgia non è più l’esperienza brutale e pericolosa che i nostri antenati affrontavano. Grazie a meraviglie come la laparoscopia, le soluzioni robotiche e, più recentemente, l’iKnife e la sonda laser, gli interventi chirurgici diventano sempre più sicuri.
Gli archeologi ritengono che la chirurgia sia stata praticata fino a 11.000 anni fa. La chirurgia cranica, nota come trapanazione, risale probabilmente all’era neolitica e prevedeva la perforazione del cranio di una persona viva.
Si specula che questa pratica fosse utilizzata per curare disturbi come convulsioni, fratture, mal di testa e infezioni. Gli antichi egizi applicavano tecniche simili per «far uscire» i mal di testa e le emicranie.
Dal 1812 in poi, vi sono stati racconti di procedure che oggi ci sembrerebbero raccapriccianti, come l’uso di un gancio per rimuovere cataratte o l’impiego di sanguisughe per il salasso. I pionieri del loro tempo, sia chirurghi che pazienti, dimostravano un notevole coraggio.
Saltiamo al presente e troviamo la chirurgia mini-invasiva, dove anche un trapianto di cuore è diventato di routine. Tra gennaio 1988 e luglio 2016, negli Stati Uniti si sono effettuati 64.055 trapianti cardiaci, secondo la United Network for Organ Sharing (UNOS).
Progressi nella chirurgia mini-invasiva
Nel 1987, un ginecologo francese eseguì il primo intervento laparoscopico per la rimozione di una cistifellea, segnando l’inizio di una rapida espansione della pratica. Secondo la Food and Drug Administration (FDA) degli Stati Uniti, oltre 2 milioni di interventi di chirurgia laparoscopica vengono eseguiti ogni anno.
La chirurgia laparoscopica, nota anche come «a buco della serratura», utilizza un piccolo tubo con una sorgente luminosa e una telecamera che vengono inseriti nel corpo per raggiungere l’area interessata. Le aree da operare vengono visualizzate su uno schermo, mentre il chirurgo manovra gli strumenti attraverso piccole aperture.
Le procedure minimamente invasive comportano incisioni più piccole, meno cicatrici, un rischio ridotto di infezione, soggiorni ospedalieri più brevi e un recupero più rapido.
Chirurgia robotica
Passiamo ora alla chirurgia robotica. Nel 2000, un team di scienziati in Germania sviluppò un sistema con due bracci robotici controllati da un chirurgo su una console. Questo sistema, chiamato ARTEMIS, segnò una svolta nelle tecniche chirurgiche.
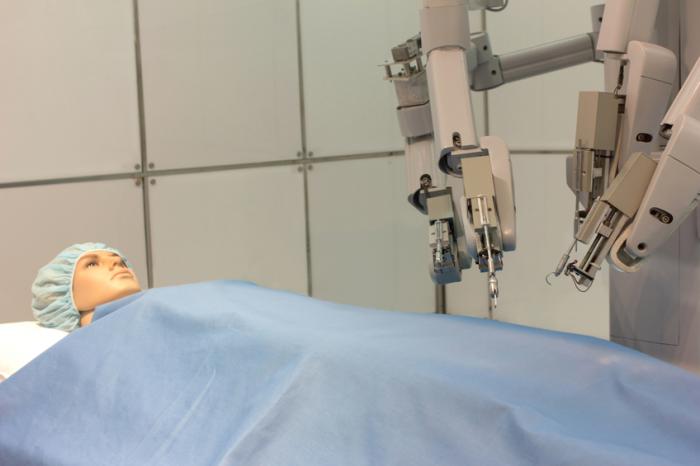
Nel luglio 2000, il sistema da Vinci ottenne l’approvazione per l’uso negli Stati Uniti per interventi chirurgici. Fu il primo sistema chirurgico robotizzato ad avere tale approvazione dalla FDA, e il suo utilizzo si diffuse rapidamente.
Il sistema comprende tre componenti: un carrello di visione con sorgenti di luce e telecamere, una console principale per il chirurgo e un carrello mobile con due bracci per gli strumenti e una fotocamera.
La fotocamera fornisce un’immagine tridimensionale, e le punte degli strumenti sembrano un’estensione delle mani del chirurgo. I pedali controllano l’elettrocauterio, la messa a fuoco della fotocamera e i bracci robotici.
Tuttavia, sono stati riportati errori e malfunzionamenti, alcuni dei quali fatali, e non tutti sono convinti che la chirurgia robotica offra realmente risultati migliori per i pazienti.
Ciò che l’occhio non può vedere
Il coltello elettrochirurgico fu inventato negli anni ’20 e utilizza una corrente elettrica per riscaldare rapidamente i tessuti, permettendo al chirurgo di tagliare con una minima perdita di sangue. È ampiamente usato nella chirurgia oncologica.
La chirurgia guidata da immagini, come la laparoscopia, ha significativamente ridotto l’invasività di molte operazioni. Tuttavia, quando si tratta di tumori, le immagini possono localizzare il tumore, ma non sono in grado di distinguere facilmente tra tessuti sani e malati.
Il dott. Zoltan Takats, dell’Imperial College di Londra, ha trovato un modo per far sì che il coltello elettrochirurgico colmi questa lacuna.
Nasce così l’iKnife. Basato su tecnologie di elettrochirurgia, l’iKnife è in grado di identificare con precisione quale tessuto deve essere rimosso e quale deve rimanere.
Fino a poco tempo fa, l’unico modo per determinare se un tessuto fosse canceroso era eseguire una biopsia, di solito al microscopio. Questo approccio ha il limite di poter analizzare solo pochi campioni durante l’intervento e può richiedere fino a 40 minuti per ogni test, un tempo non pratico per definire il confine di un tumore.
Nel 2013, è emerso il primo iKnife, che consente al chirurgo di analizzare il tessuto biologico associando l’elettrochirurgia alla spettrometria di massa. Questa tecnica utilizza particelle ionizzate che attraversano campi elettrici o magnetici.
La spettrometria di massa fornisce misurazioni del rapporto massa-carica, consentendo di distinguere tra tessuti di composizione diversa, noti come profilatura chimica. Analizzando la composizione chimica dei campioni, è possibile identificare quali tessuti sono sani e quali no.
All’epoca, il dott. Takats si aspettava che l’iKnife potesse essere utilizzato in vari tipi di chirurgia, con un impatto positivo sui costi.
Come funziona l’iKnife
Il taglio con un electroscalpel provoca la vaporizzazione del tessuto, creando un fumo che viene normalmente aspirato. Collegando l’iKnife a uno spettrometro di massa e aspirando il fumo, il vapore può essere «catturato» e analizzato per la sua composizione chimica. Abbinando i risultati a una libreria di riferimento, il chirurgo può identificare il tipo di tessuto in meno di 3 secondi.
Nel 2013, il Dr. Takats e il suo team hanno utilizzato l’iKnife per analizzare campioni di tessuto prelevati da 302 pazienti sottoposti a interventi per rimuovere diversi tipi di tumore, sia maligni che benigni.
Hanno registrato le caratteristiche di migliaia di campioni prelevati da tumori nel cervello, polmoni, torace, stomaco, colon e fegato. Da questi campioni, hanno creato un database di 1.624 voci cancerose e 1.309 non cancerose, utile per confrontare campioni futuri.
Il team ha quindi impiegato l’iKnife con la spettrometria di massa a ionizzazione evaporativa rapida (REIMS) in 81 interventi chirurgici. Durante questi interventi, sono state effettuate letture in tempo reale e il tessuto è stato testato successivamente in modo convenzionale. In ogni caso, le letture corrispondevano esattamente alla diagnosi istologica post-operatoria.
L’iKnife è stato progettato per l’elettrochirurgia perché i chirurghi ne riconoscevano il potenziale per la rimozione di tumori maligni, ma la sua applicabilità è stata sollevata anche per la chirurgia idro e laser. In futuro, potrebbe essere utilizzato per analizzare membrane mucose e tessuti del sistema respiratorio, urinogenitale o gastrointestinale.
Attualmente, l’iKnife è in uso presso l’Imperial College di Londra e sta entrando nella fase di sperimentazione nella chirurgia oncologica per il cancro al seno, al colon e alle ovaie.
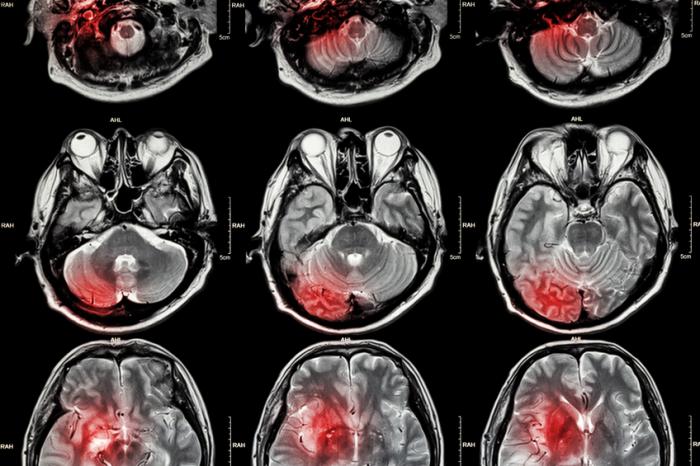
Rilevazione laser di tumori cerebrali
Recentemente, ricercatori del Regno Unito e del Canada hanno combinato l’iKnife con una sonda laser per identificare tessuti anormali durante l’intervento per rimuovere un tumore al cervello.
Questa tecnica utilizza una sonda laser nel vicino infrarosso per determinare se un tessuto è canceroso o sano, misurando la luce riflessa dal tessuto.
Fatti veloci sui progressi della chirurgia
- Il primo uso riuscito di etere anestetico fu nel 1846
- L’acido carbolico fu usato per la prima volta come antisettico tra il 1867 e il 1876
- Nel 1907 fu creato il primo antibiotico artificiale.
Quando il raggio di luce veniva diretto sul cervello esposto, le molecole nelle cellule iniziavano a vibrare. Le fibre ottiche nella sonda raccoglievano la luce diffusa dal tessuto.
Misurando la frequenza delle vibrazioni, gli scienziati erano in grado di identificare quale tessuto fosse sano e quale no. Come per l’iKnife, anche in questo caso l’analisi richiedeva solo pochi secondi.
Nella chirurgia oncologica, la capacità di rilevare il confine preciso di un’area di tessuto maligno può significare la differenza tra vita e morte e tra dover ripetere un intervento o meno.
Essere in grado di rimuovere il tessuto esatto non solo garantisce l’asportazione completa del tumore, ma riduce anche la perdita di tessuto sano, ottenendo risultati migliori per i pazienti.
I ricercatori osservano che, specialmente con i tumori cerebrali, l’incapacità di vedere il confine di un tumore, anche con l’ausilio di un microscopio chirurgico, espone i pazienti a un rischio maggiore di danni, come la perdita della parola. Con il progresso della tecnologia, i rischi associati alla chirurgia stanno progressivamente diminuendo.
Nuove scoperte e ricerche aggiornate (2024)
Negli ultimi anni, la ricerca sulla chirurgia oncologica ha fatto passi da gigante. Nuove tecniche come la chirurgia a guida molecolare e l’uso di intelligenza artificiale stanno emergendo come strumenti promettenti per migliorare la precisione degli interventi. Ad esempio, studi recenti hanno mostrato che l’uso di algoritmi di apprendimento automatico può aiutare i chirurghi a pianificare le operazioni in modo più efficace, analizzando i dati dei pazienti e prevedendo i risultati.
Inoltre, la combinazione di tecnologie come la tomografia a coerenza ottica (OCT) e la spettrometria di massa sta diventando sempre più comune, permettendo una valutazione in tempo reale dei tessuti durante gli interventi. Queste tecnologie non solo migliorano la sicurezza, ma anche l’efficacia delle procedure chirurgiche.
Studi recenti hanno anche dimostrato che l’uso di terapie adiabatiche, che sfruttano il calore per distruggere le cellule tumorali, può essere un complemento efficace all’iKnife, aumentando ulteriormente le possibilità di successo degli interventi. La ricerca continua a esplorare come queste tecnologie possano essere integrate nella pratica clinica quotidiana, portando a risultati sempre migliori per i pazienti affetti da tumori.